Genomas a partir de metagenomas
La metagenómica hace referencia al estudios de todo el ADN de los organismos que se encuentran en un ambiente. La secuenciación de este material genético produce lecturas que pueden ensamblarse para conocer la diversidad microbiana y sus funciones.
Típicamente los metagenomas pueden estudiarse mediante dos aproximaciones:
- La clasificación taxonómica de contigs o lecturas y la inferencia metabólica de los contigs.
- La reconstrucción de genomas a partir de metagenomas (MAGs), clasificación taxonómica y la inferencia metabólica de los MAGs.
En este apartado nos enfocaremos en la segunda aproximación. Los MAGs se reconstruyen a partir de un ensamble metagenómico, los contigs de dicho ensamble se agrupan mediante la información de cobertura y frecuencia de tetranucleótidos. Esta agrupación puede generar errores, por lo que es indispensable evaluar la calidad de los MAGs mediante la completitud y redundancia de genes de copia única (MerenLab y col.)
Para obtener MAGs podemos seguir el siguiente flujo de análisis:

En los días anteriores aprendieron a evaluar la calidad de las lecturas, filtrarlas y ensamblarlas, por lo que este apartado comenzará con un ensamble ya generado.
De acuerdo con el flujo de análisis (Figura 2), debemos partir de un ensamble y mapear las lecturas y obtener un archivo de profundidad de cada contig en el ensamble.
El proceso de mapeo es demandante en tiempo de ejecución y recursos. Así que nos dimos a la tarea de generar el archivo de profundidad para comenzar directamente con el binning.
El mapeo lo corrimos con bowtie2 que es una herramienta confiable y muy utilizada para alinear lecturas cortas a una referencia, en nuestro caso, la referencia es el ensamble metagenómico de la muestra de 48hrs. Bowtie2 genera un archivo de mapeo (SAM) que debe convertirse a un formato binario (BAM), para esta conversión usamos samtools que contiene multiples subherramientas para trabajar con archivos de mapeos.
Para generar este archivo se utilizaron las siguientes lineas de código.
# Formatear el ensamble
bowtie2-build results/02.ensambles/megahit/48hrs/48hrs.fasta results/03.profundidad/48hrs --threads 40
# Mapear las lecturas contra el ensamble
bowtie2 -x results/03.profundidad/48hrs -1 data/48hrs_sm_R1.fastq -2 data/48hrs_sm_R2.fastq -p 40 -S results/03.profundidad/48hrs.sam
# Convertir de SAM a BAM y ordenar
samtools view -Sb -O BAM -@ 40 results/03.profundidad/48hrs.sam | samtools sort -@ 40 -o results/03.profundidad/48hrs_sorted.bam
# Obtener el índice
samtools index results/03.profundidad/48hrs_sorted.bamYa que generamos el archivo bam ordenado y el índice obtuvimos un archivo con la información de cobertura de cada contig dentro del ensamble, este archivo de profundidad se generó con jgi_summarize_bam_contig_depths que es una herramienta desarrollada por el JGI.
# jgi
#Obtener el archivo de profundidad de cada contig
jgi_summarize_bam_contig_depths --outputDepth results/03.profundidad/48hrs.mgh_depth.txt results/03.profundidad/48hrs_sorted.bamNo las ejecutes, sólo son un ejemplo para que las puedas usar con tus propios datos en el futuro.
Antes de comenzar, reúnete con tu equipo y juntos
Revisen nuevamente el contenido de los directorios
02.ensamblesy03.profundidad.txtDiscutan y en una diapositiva expliquen el flujo teórico que se siguió para obtener los archivos que están en esos directorios.
La liga de drive para ir trabajando durante el taller es esta: https://docs.google.com/presentation/d/1f4vaJ_fV_8-i-dja2wtFx55vRkgeAB5Y4s-opCvFI1k/edit?usp=sharing
Por si te pierdes
Sólo por si te pierdes
Si en algún momento te pierdes entre directorios, puedes regresar al espacio principal asi:
cd && cd taller_metagenomica_pozol/Binning
Ahora si, vamos a agrupar los contigs del metaensamble en bins …
Metabat2
Metabat2 es una herramienta que agrupa los contigs tomando la cobertura de cada contig y calcula su composición nucleotídica.
Para correr metabat necesitamos activar el ambiente conda donde se aloja.

conda activate metabat2
Ahora que ya tenemos el ambiente activado vamos a crear nuestro script de slurm para ejecutarlo.
nano src/04.metabat.slurm#!/bin/bash
#SBATHC -J Metabat2
#SBATCH -t 0
#SBATCH -e outs/04.metabat.err
#SBATCH -o outs/04.metabat.out
#SBATCH --export=ALL
#SBATCH -n 6
#SBATCH -p q2
#SBATCH --mem 8G
metabat2 -i results/02.ensambles/48hrs.fasta -a results/03.profundidad/48hrs.mgh_depth.txt -o results/04.metabat/metabat -t 6 -m 1500Guarda tecleando ctrl + o enter y después ctrl + x enter
Y ejecuta:
sbatch src/04.metabat.slurm- ¿Cuántos bins se formaron?
ls results/04.metabat/
Ya que corrimos Metabat2 vamos a ejecutar MaxBin2, pero primero necesitamos desactivar el ambiente:
Para desactivar el ambiente debemos correr la siguiente linea:
conda deactivateMaxBin2
MaxBin2 agrupa los contigs de acuerdo a la información de cobertura, composición nucleotídica y genes de marcadores de copia única.
Vamos a ejecutarlo, activemos el ambiente conda donde se encuentra maxbin.
conda activate metagenomics
Ahora si, vamos a crear el script y ejecutarlo.
nano src/05.maxbin.slurm#!/bin/bash
#SBATHC -J Maxbin
#SBATCH -t 0
#SBATCH -e outs/05.maxbin.err
#SBATCH -o outs/05.maxbin.out
#SBATCH --export=ALL
#SBATCH -n 6
#SBATCH -p q2
#SBATCH --mem 8G
#Crea el directorio para los resultados de MaxBin2
mkdir -p results/05.maxbin
# Linea para correrlo
run_MaxBin.pl -thread 6 -min_contig_length 1500 -contig results/02.ensambles/48hrs.fasta -out results/05.maxbin/48hrs_maxbin -abund results/03.profundidad/48hrs.mgh_depth.txtY lo ejecutamos:
sbatch src/05.maxbin.slurmResponde
1. ¿Cuántos bins se formaron?
2. ¿Qué porcentaje de completitud tienen??
ls results/05.maxbin/*.fasta | wc -lcat results/05.maxbin/48hrs_maxbin.summary | column -t
conda deactivateVamb
VAMB utiliza una combinación de enfoques de aprendizaje profundo y técnicas de agrupamiento basándose en sus patrones de composición de nucleótidos y en la co-ocurrencia de sus frecuencias de cobertura.
conda activate mt-vamb
Crea el script para vamb:
#!/bin/bash
#SBATHC -J Vamb
#SBATCH -t 0
#SBATCH -e outs/06.vamb.err
#SBATCH -o outs/06.vamb.out
#SBATCH --export=ALL
#SBATCH -n 6
#SBATCH -p q2
#SBATCH --mem 8G
#Crea el directorio para los resultados de vamb
mkdir -p results/06.vamb
# La linea para vamb
vamb --fasta results/02.ensambles/48hrs.fasta --bamfiles results/03.profundidad/48hrs_sorted.bam --minfasta 500000 --outdir results/06.vamb/48hrsSi quisieras recuperar los genomas de virus ¿Qué cambiarías?
Recientemente se publicó COMEBin, que utiliza un enfoque distinto a lo que hemos usado en este tutorial. En el siguiente link encontrarás el manual y una explicación general sobre su funcionamiento.
conda deactivateRefinamiento
Ya corrimos tres programas de binning, pero, recordemos que los agrupamientos pueden tener errores:

Para disminuir la contaminación e incrementar la completitud hay algunos programas que pueden ayudarnos. Entre ellos están Binning_refiner y DASTool.
CheckM
Antes de proceder al refinamiento es necesario tener claro cómo se evalúa la completitud y contaminación de los bins. Para esta evaluación se usa CheckM que se ha convertido en una herramienta estándar para la evaluación de la calidad de genomas y MAGs, y es usada por la mayoría de programas de refinamiento.
Para hacer esta evaluación, CheckM utiliza una serie de herramientas: tree organiza los genomas en un árbol de referencia. tree_qa evalúa la cantidad de genes marcadores filogenéticos y su ubicación en el árbol. El comando lineage_set crea un archivo de marcadores específicos de linaje, que se usa en el comando analyze para evaluar la integridad y contaminación de los genomas. Finalmente, el comando qa genera tablas que resumen la calidad de los genomas.

En este taller no vamos a correr CheckM para los resultados de cada binneador porque uno de los programas de refinamiento que usaremos ya lo corren de forma interna, sin embargo, es útil correrlo para tener una idea clara sobre la calidad de los bins que vamos obteniendo.
Vamos a correrlo sólo como ejemplo para los resultados de Vamb para que podamos conocerlo.
Activamos el ambiente:
conda activate checkm#!/bin/bash
#SBATHC -J checkm
#SBATCH -t 0
#SBATCH -e outs/06b.checkm.err
#SBATCH -o outs/06b.checkm.out
#SBATCH --export=ALL
#SBATCH -n 6
#SBATCH -p q2
#SBATCH --mem 8G
#Crea el directorio para los resultados de vamb
mkdir -p results/06.vamb
# La linea para vamb
vamb --fasta results/02.ensambles/48hrs.fasta --bamfiles results/03.profundidad/48hrs_sorted.bam --minfasta 500000 --outdir results/06.vamb/48hrs
# Ejemplo de como correrlo con los bins de vamb
# llamamos a las bases de datos
export CHECKM_DATA_PATH=/lustre/databases/metagenomica/checkM/
# ejecutamos checkm
checkm lineage_wf results/06.vamb/48hrs/bins/ results/06.vamb/48hrs/checkm -x fna -t 4 -f results/06.vamb/48hrs/checkm_vamb.txtY ahora si, a refinar los bins … 🥳
Binning_refiner
Binning_refiner se enfoca en refinar y fusionar los bins para mejorar la integridad y reducir la contaminación. Identifica bins que pueden representar el mismo genoma y los fusiona. Después elimina posibles contaminaciones, durante el proceso, Binning_refiner evalúa la calidad de los bins.
https://doi.org/10.1093/bioinformatics/btx086
Necesitamos crear el directorio de resultados para binning_refiner y un directorio con los bins generados por cada programa
mkdir -p results/07.binning_refiner/48hrsbins/{metabat,maxbin,vamb}Ahora vamos a crear ligas simbólicas de los bins generados por cada herramienta.
#metabat
cd results/07.binning_refiner/48hrsbins/metabat/
ln -s ../../../04.metabat/*.fa .
#maxbin
cd ../maxbin/
ln -s ../../../05.maxbin/*.fasta .
# vamb
cd ../vamb/
ln -s ../../../06.vamb/48hrs/bins/*.fna .
#regresar
cd ../../Ahora si, corramos Binning_refiner
conda activate mt-das-toolBinning_refiner -i 48hrsbins/ -p 48hrsY regresemos a nuestro directorio principal
cd && cd taller_metagenomica_pozol/Exploremos los resultados!
cat results/07.binning_refiner/48hrs_Binning_refiner_outputs/48hrs_sources_and_length.txtCopia y pega este contenido en la consola de Rscript
# Cargar las librerias
library(dplyr)
library(networkD3)
# revisa tu ubicación
getwd()
# OJO
setwd("/home/ELALUMNOQUEERES/taller_metagenomica_pozol")
# Cargar los datos
sankey_data <- read.csv("results/07.binning_refiner/48hrs_Binning_refiner_outputs/48hrs_sankey.csv")
# Crear una lista de nodos únicos
nodes <- data.frame(name = unique(c(sankey_data$C1, sankey_data$C2)))
# Crear el dataframe de enlaces
links <- sankey_data %>%
mutate(source = match(C1, nodes$name) - 1,
target = match(C2, nodes$name) - 1,
value = Length_Kbp) %>%
select(source, target, value)
# Crear el gráfico Sankey
sankey_plot <- sankeyNetwork(Links = links, Nodes = nodes,
Source = "source", Target = "target",
Value = "value", NodeID = "name",
fontSize = 12, nodeWidth = 30)
# Mostrar el gráfico
sankey_plot
# Guardar
library(htmlwidgets)
saveWidget(sankey_plot, file = "48hrs_sankey_plot.html")
DASTool
DASTool es una herramienta utilizada para mejorar la calidad de los bins. Evalúa la integridad, combina los resultados de diferentes bineadores y por consenso selecciona los mejores bins de cada herramienta. Una vez que DASTool ha seleccionado los mejores bins, realiza un proceso de refinamiento para optimizar los resultados.
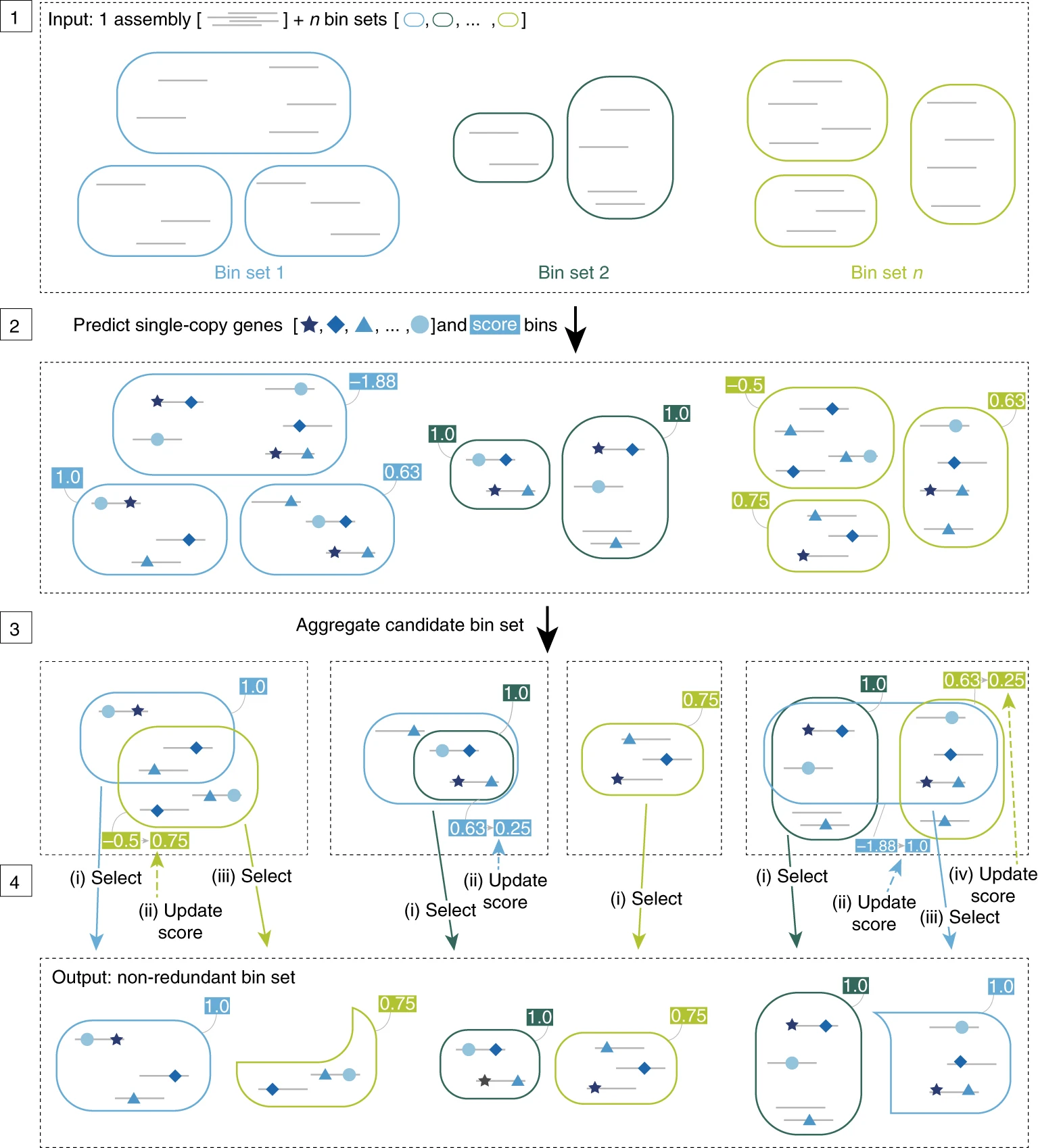
Vamos a correr DASTool … 🥳
nano src/08.dastool.slurm#!/bin/bash
#SBATHC -J dastool
#SBATCH -t 0
#SBATCH -e outs/08.dastool.err
#SBATCH -o outs/08.dastool.out
#SBATCH --export=ALL
#SBATCH -n 6
#SBATCH -p q2
#SBATCH --mem 8G
export LC_ALL=en_US.UTF-8
# Crear el directorio para los resultados
mkdir -p results/08.dastool
# DASTool necesita como entrada un archivo tabular con información de los resultados de cada programa de binning.
Fasta_to_Contig2Bin.sh -i results/04.metabat/ -e fa > results/08.dastool/48hrs_metabat.dastool.tsv
Fasta_to_Contig2Bin.sh -i results/05.maxbin/ -e fasta > results/08.dastool/48hrs_maxbin.dastool.tsv
Fasta_to_Contig2Bin.sh -i results/06.vamb/48hrs/bins/ -e fna > results/08.dastool/48hrs_vamb.dastool.tsv
# Ya que tenemos los archivos tsv podemos empezar con el refinamiento!!
DAS_Tool -i results/08.dastool/48hrs_metabat.dastool.tsv,results/08.dastool/48hrs_maxbin.dastool.tsv,results/08.dastool/48hrs_vamb.dastool.tsv -l metabat,maxbin,vamb -c results/02.ensambles/48hrs.fasta -o results/08.dastool/48hrs -t 4 --write_binsDereplicación
dRep
La desreplicación es el proceso de identificar conjuntos de genomas que son “iguales” en una lista de genomas y eliminar todos los genomas excepto el “mejor” de cada conjunto redundante. dRep es una herramienta útil para esto.
Ya que tenemos los resultados de los dos refinadores ejecutaremos dRep para desreplicar y seleccionar el mejor representante de cada bin.
Primero vamos a crear el directorio de resultados para dRep.
mkdir -p results/09.drep/binsY entraremos al directorio bins dentro del directorio de resultados para colocar los bins que queremos comparar. En este caso los generados por ambos refinadores.
cd results/09.drep/bins/Con las siguientes lineas podemos copiar los bins en este directorio:
for i in $(ls ../../08.dastool/48hrs_DASTool_bins/*.fa) ; do name=$(basename $i .fa); cp $i $name".fasta" ; done
cp ../../07.binning_refiner/48hrs_Binning_refiner_outputs/48hrs_refined_bins/*.fasta .Ya que los copiamos, regresemos al directorio principal.
cd && cd taller_metagenomica_pozol/Y ahora si, vamos a correr dRep …
#!/bin/bash
#SBATHC -J rdep
#SBATCH -t 0
#SBATCH -e outs/09.drep.err
#SBATCH -o outs/09.drep.out
#SBATCH --export=ALL
#SBATCH -n 1
#SBATCH -p q2
#SBATCH --mem 160G
export CHECKM_DATA_PATH=/lustre/apps/spack/opt/spack/linux-centos8-ivybridge/gcc-8.3.1/miniconda3-4.7.12.1-ubp7tlghaseisza4pqufq6sbehwa4pog/envs/mt-das-tool/db
if [[ -d results/09.drep/bins ]]
then
rm -fr results/09.drep/bins
fi
mkdir -p results/09.drep/bins
cd results/09.drep/bins/
for i in $(ls ../../08.dastool/48hrs_DASTool_bins/*.fa)
do name=$(basename $i .fa)
cp $i $name".fasta"
done
cp ../../07.binning_refiner/48hrs_Binning_refiner_outputs/48hrs_refined_bins/*.fasta .
cd ../../..
dRep dereplicate results/09.drep/ --debug -p 1 -comp 50 -con 10 -g results/09.drep/bins/*.fastaEste es uno de los plots generados por dRep, que representa los mejores bins desreplicados.

Vamos a desactivar el ambiente de dRep
conda deactivateEn la vida real, si el proyecto de metagenómica que estás desarrollando tiene librerías de diferentes muestras usarías dRep entre todos los conjuntos de bins ya refinados para no tener redundancia de genomas.
Qué harías si antes de desreplicar tienes un bin que tiene 98 % de completitud y 11 % de contaminación?. dRep en automático lo descartaría.
Propondrías alguna manera para quedarte con este bin y curarlo para reducir su contaminación?
Por suerte hay más programas que pueden ayudarnos a curar nuestros bins manualmente, una herramienta útil para esto es mmgenome2
Ya que tenemos los bins refinados y desreplicados opcionalmente podrías reensamblarlos. La manera sería mapear las lecturas de toda la muestra a los bins finales y con las lecturas mapeadas y el bin, generar un ensamble genómico para cada uno. Con esta aproximación se genera un MAG más pulido y la contaminación se reduce.
Aunque en muchos reportes verás que los autores reensamblan sus MAGs, en otros no lo hacen y no hacerlo no está mal, pero hacerlo mejora la calidad.
Ahora te toca a tí
Ahora te toca a tí.
Reúnanse en equipos y repliquen todo el flujo hasta este punto con la muestra que les toca.
Discutan cada resultado obtenido.
En la carpeta compartida de Drive busquen la presentación para el Ejercicio 2, en la diapositiva correspondiente resuman sus resultados obtenidos para que los presenten.
Tiempo de actividad (1.5 hr)
Tiempo de presentación de resultados (5 min por equipo)


